科研进展
Cell Systems | 复杂生物振荡中的“三体问题”
2023年5月17日,中国科学院深圳先进技术研究院合成生物学研究所细胞与基因线路设计中心魏平课题组与丹麦皇家科学院院长Mogens H. Jensen课题组合作在Cell Systems上发表研究论文“Coupled oscillator cooperativity as a control mechanism in chronobiology”,通过合成生物学方法构建了一种三元耦合振荡系统,并结合数学模型,首次深入地探讨了生命系统中多重耦合振荡系统中的调控机理。

文章上线截图
文章链接:https://doi.org/10.1016/j.cels.2023.04.001
物理世界中,多个振荡波的相互叠加可能产生干涉条纹等复杂现象。事实上,周期振荡式的动力学行为不仅出现在物理现象中,在生命系统内也广泛存在。从生物钟、体节发育、神经冲动,到细胞周期、免疫调控、信号转导,生物系统中各组分的周期性变化帮助我们维持稳定的节律、产生正确的发育结构、对外界信息做出精准而定量的响应;在这些过程中,往往会涉及到多种振荡信号之间的相互作用。这种复杂系统中蕴含着怎样的调控原理,是一个重要却难解的问题。
同频振荡波的干涉(图片来自网络)

小鼠体节发育中Hes7的行波(引自Yoshioka-Kobayashi et al., 2020)
图1 物理系统与生物系统中的振荡
早在17世纪,物理学家惠更斯就发现两个相互耦合的钟摆在特定条件下可以发生神奇的同步现象,对这类问题的研究促生了非线性动力学中著名的耦合振子模型(coupled oscillators)。这一模型可以预测两个彼此关联(或单向关联)的振子在何种条件下产生锁频、多稳态极限环以及混沌。然而,经典耦合振子模型刻画的只是振子数n=2的简单情况,无法探讨真实生物系统中当n≥3时多种振荡信号同时存在带来的复杂性。多个振子会使系统变得更混乱还是更稳定?这其中是否存在全新的调控机理? 探索这一问题不仅需要在理论模型上进行拓展,更需要简洁明了、没有干扰的实验体系。

两节拍器通过底部木板相互作用形成反相同步(图片来自网络)

大肠杆菌中的合成振荡系统被周期性阿拉伯糖刺激所同步(引自Mondragón-Palomino et al., 2011)
图2 机械系统与生物系统中的耦合振子
为了探究这一问题,本文作者对前期在酵母细胞中人工构建的NF-κB振荡系统(Zhang et al., 2017)进行了改造,进一步增加了系统的复杂度,实现系统能够受到两种外部信号的控制。该系统的核心设计是基于人体细胞中的与免疫响应相关的NF-κB/IκB信号分子构成的负反馈线路,通过信号分子嫁接的方式,在酵母细胞中形成NF-κB的周期性激活过程。利用微流控芯片系统,作者可以精确编程两种外部输入信号的振荡周期与强度,从而实现了2个部周期信号与1个内部周期信号相互作用的三振荡系统,为研究生命过程中多振荡耦合问题提供了可定量调控的活细胞实验系统。
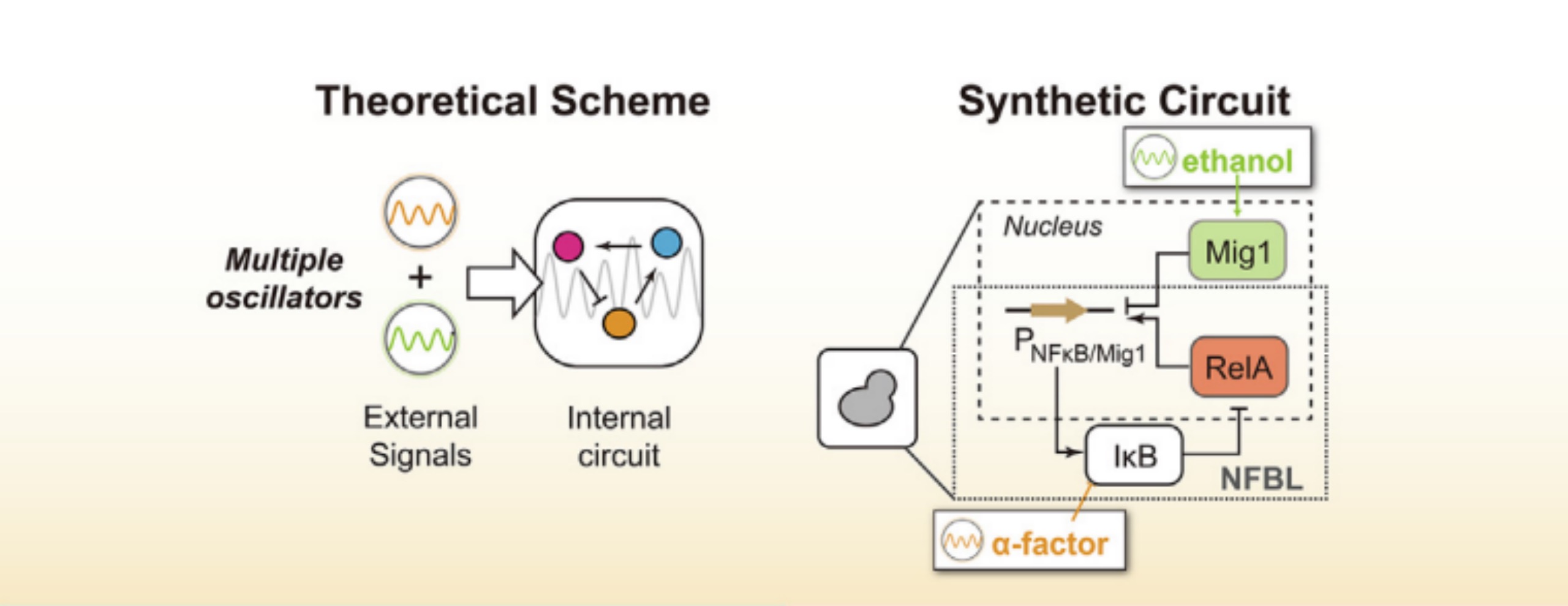
图3 双输入振荡系统的基本设计
基于这一系统结合数学模型,作者发现,双重周期信号同时存在能够显著地提高内外振荡同步化的范围、降低细胞群体振荡动力学的差异、提高同步化细胞在群体中所占的比例。模型模拟结果更表明,双输入条件能够推迟混沌的发生。这些结果说明了外界两种周期信号对系统的作用并不是简单的线性叠加,而是以一种相互协同的形式产生作用。
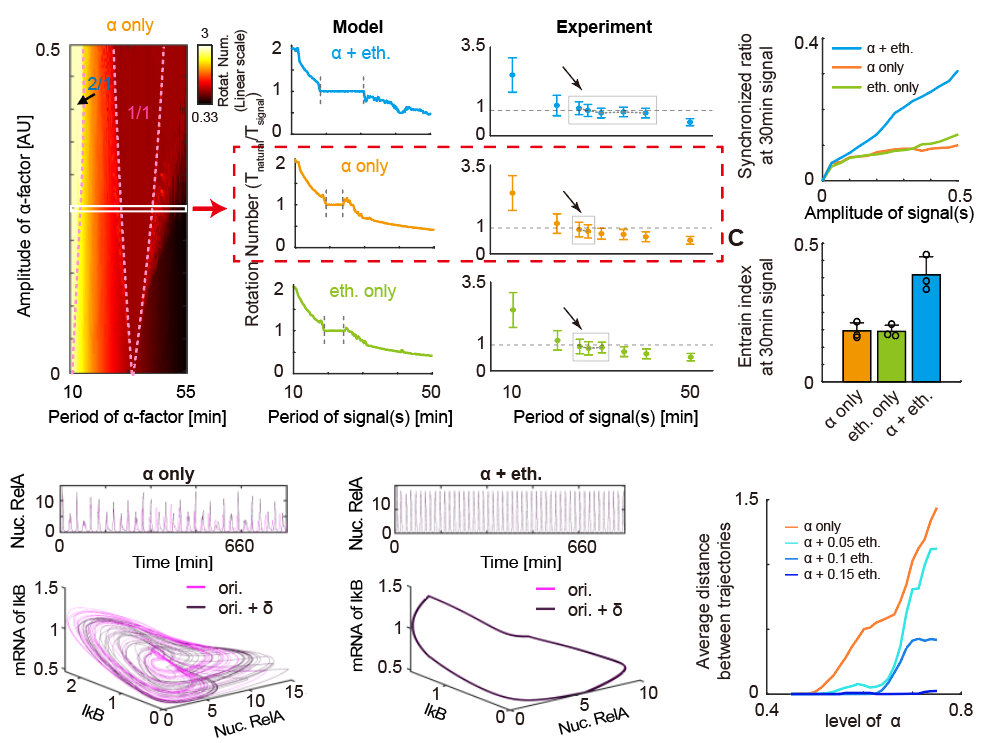
图4 双重周期信号扩大同步范围、提高同步化细胞比例、延迟混沌发生
进一步,作者注意到调整外界信号间的相位差能够非常明显地改变内部振荡的振幅,而保持内部振荡周期不变,从而实现理论上严格的“调幅不调频”。深入探究表明,带来最大振幅的信号相位组合与内部系统的动力学参数之间存在高度相关性。为了验证以上结论的普适性,作者还选取了三个不同的振荡系统进行数值模拟。在范德波尔振子、p53振荡系统和天然NF-κB振荡系统中,以上结论均得到很好的重复。
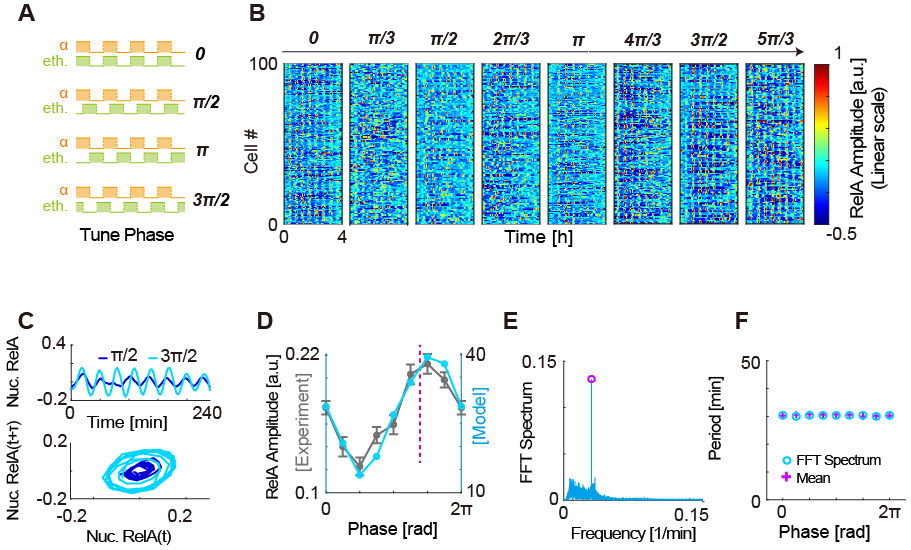
图5 调控外界周期信号相位实现调幅不调频
最后,通过引入下游荧光报告基因,作者在实验和模型中确认了这种相位调整带来的振幅变化的确能造成基因表达水平的差异。这种差异与振荡的基线水平、振荡周期均无关。
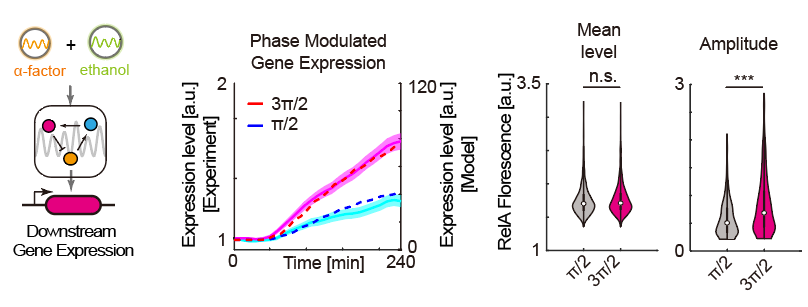
图6 通过改变外界周期信号间相位差,调控基因表达
本项研究首次同时在实验和理论水平揭示了多耦合振荡系统中的协同性现象,发现了这类系统中独特的相位调控原理,拓宽了学界对于生物耦合振荡系统的认识,以及对生物学中时间调控的理解。本研究中构建的双输入人工合成振荡系统,可为后续进一步探索多耦合振荡中的基本问题提供稳健、可靠的实验平台。这种从根本上理解生命系统设计原理的工作,为人工设计合成生命、理解复杂疾病的发生机理提供了重要的理论基础。
哥本哈根波尔研究所Mathias S. Helberg博士(中科院深圳先进院访问学者)、北京大学定量生物学中心博士研究生姜源旭(中科院深圳先进院客座学生)、中科院深圳先进院博士后范盈盈(原北京大学定量生物学中心博士)为本文的共同第一作者。中科院深圳先进院魏平研究员与哥本哈根大学玻尔研究所Mogens H. Jensen教授为本文的共同通讯作者。北京大学定量生物学中心欧阳颀院士、钱珑研究员对本项研究提供了宝贵的指导和意见。北京大学定量生物学中心博士研究生林维、原北京大学定量生物学中心博士张志博对本研究的前期结果提供了重要贡献。本项研究获得了科技部重点研发计划项目、国家自然科学基金项目、中国科学院战略重点研究项目及深圳合成生物学创新研究院等项目的支持。
参考文献
1. Yoshioka-Kobayashi, K., Matsumiya, M., Niino, Y., Isomura, A., Kori, H., Miyawaki, A., & Kageyama, R. (2020). Coupling delay controls synchronized oscillation in the segmentation clock. Nature, 580, 119-123.
2. Mondragón-Palomino, O., Danino, T., Selimkhanov, J., Tsimring, L.S., & Hasty, J. (2011). Entrainment of a Population of Synthetic Genetic Oscillators. Science, 333, 1315 - 1319.
3. Zhang, Z., Wang, Q., Ke, Y., Liu, S., Ju, J., Lim, W.A., Tang, C., & Wei, P. (2017). Design of Tunable Oscillatory Dynamics in a Synthetic NF-κB Signaling Circuit. Cell systems, 5 5, 460-470.e5 .




