Appl Mater Interfaces | 基于可程控卷曲粘合天然多糖水凝胶的生物适配界面
近日,中国科学院深圳先进技术研究院医工所智能材料中心杜学敏研究员团队与中国地质大学(北京)李金洪教授研究团队合作,设计构建了基于NHS酯修饰海藻酸钠和壳聚糖双层水凝胶的生物适配界面,可在湿润生理条件下程控卷曲成管并快速粘合,实现与表面高曲率组织如小口径血管的免缝合、共形、稳定的界面适配(图1)。近期,该研究工作以“Morphing-to-adhesion polysaccharide hydrogel for adaptive biointerfaces”为题在材料领域高水平期刊ACS Applied Materials & Interfaces(IF: 10.383)上在线发表。杜学敏研究员是该论文通讯作者,中国地质大学(北京)李金洪教授为论文共同通讯作者,先进院客座硕士生王姗姗与赵启龙副研究员为论文共同第一作者。
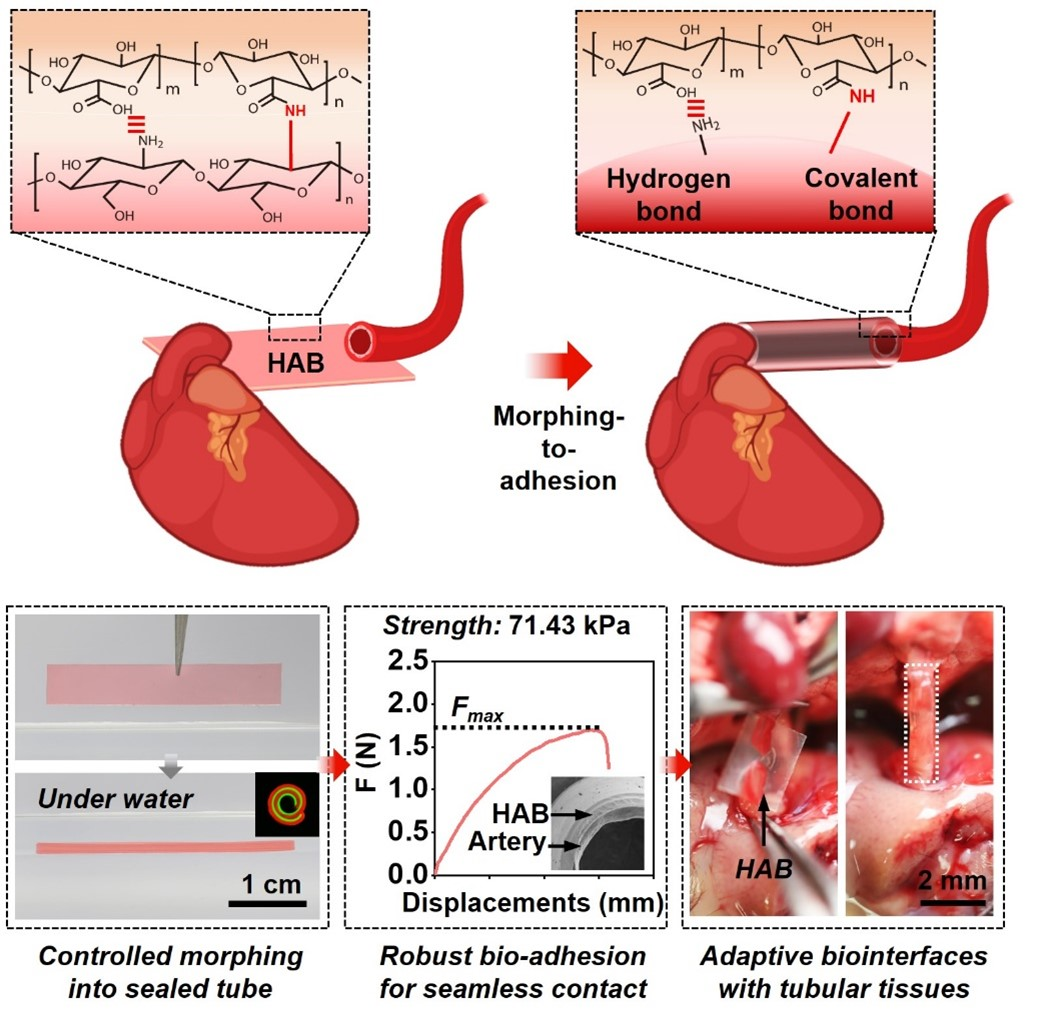
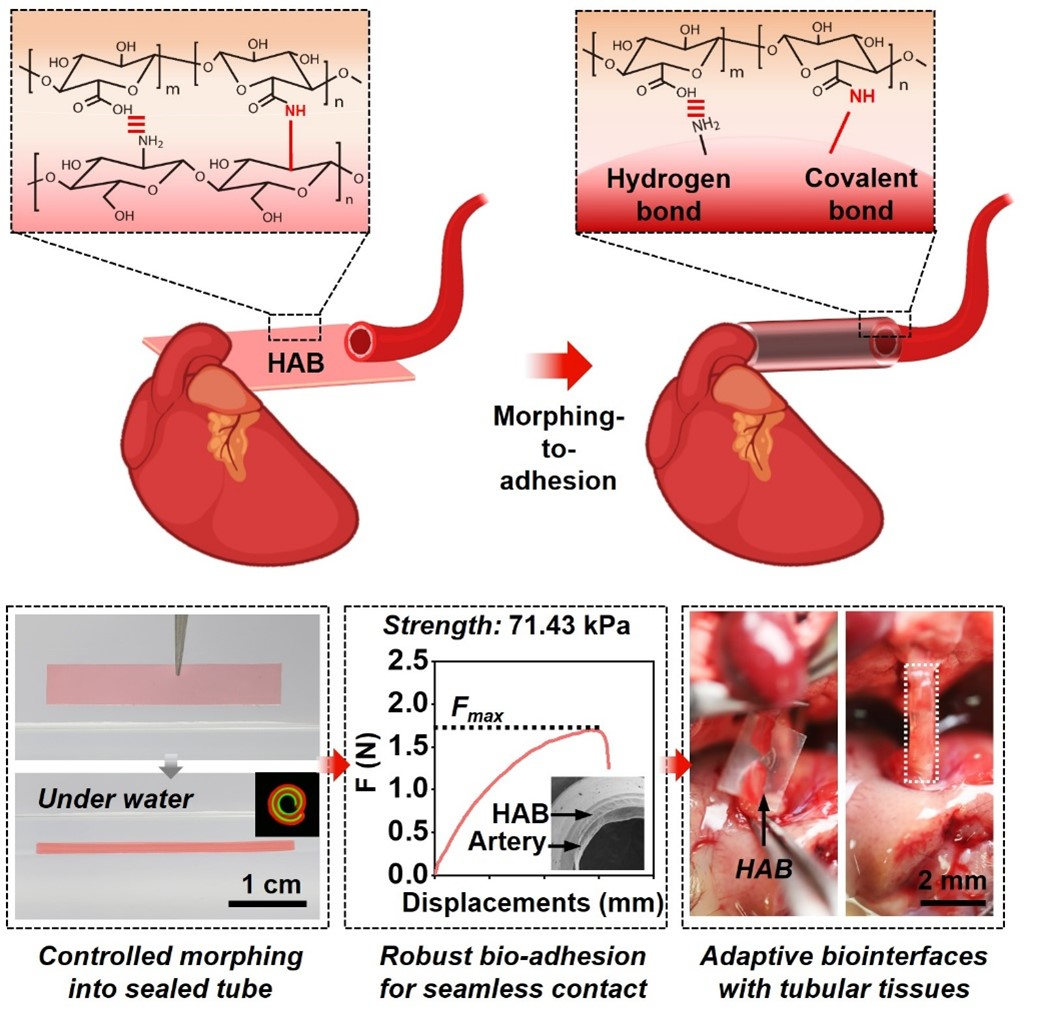
图1 多糖水凝胶基自适应生物界面(HAB)通过可控形变和快速湿粘合,实现与高表面曲率生物组织如小口径血管的免缝合、共形、稳定整合
植入式生物医用材料/器械如组织工程支架、神经电子在疾病诊疗中发挥着日趋重要的角色。植入式生物医用材料/器械的安全性和功能可靠性极大程度上依赖其植入后能与周围生物组织实现共形、稳定且生物相容的界面适配。然而,现有策略还难以满足复杂的界面适配要求。基于团队前期在多功能刺激响应高分子(Adv. Funct. Mater. 2020, 30 (10), 1909202; Matter 2019, 1, 626.)、天然多糖水凝胶形态编辑(Research 2021, 2021, 9786128; Research 2019, 2019, 6398296.)、以及生物界面适配(Natl. Sci Rev 2020, 7 (3), 629-643; Adv. Funct. Mater. 2018, 28,)方面的研究基础,我们使用海洋中广泛存在的天然多糖(海藻酸钠和壳聚糖),结合对海藻酸钠的NHS酯分子修饰和双层结构设计,构建了可程控卷曲成管并自粘合封闭的多功能天然多糖水凝胶基自适应生物界面(HAB)。
基于HAB双层水凝胶间的溶胀差异,HAB在遇水或含水的生理溶液时,可从初始的薄膜形态自发卷曲成管状;通过调控水凝胶双层的不同厚度比,还可按需调整所形成微管的管径。并且,基于NHS酯分子修饰海藻酸盐与壳聚糖之间极强的分子间相互作用(氢键和共价键),构成该HAB的这两种水凝胶可在含水环境下乃至水下实现快速(<10 s)、稳定(界面粘合韧性>300 J·m?2)粘合。而鉴于其程控形变和快速湿粘合功能,HAB能够卷曲后形成自封口的微管。并且,这种无需任何外力塑形得到的凝胶微管在远高于主动脉径流流速的血液高流速剪切冲击或生理溶液的长时间浸泡下,仍能够保持理想的结构稳定性。
此外,由于其天然多糖水凝胶组分,HAB还呈现了优异的生物相容性和生物活性:不但可支持细胞在其表面极高的细胞活性和增殖能力,还可有效支持细胞在其表面形成粘着斑并进一步支持细胞间联接的充分形成,预示了其在支持组织再生修复方面的潜力。
最后,我们进一步验证了HAB作为自适应生物界面与高表面曲率(2.8 × 102~1.3 × 103 m-1)的多种生物组织共形、稳定整合的能力。特别是,在湿润生理条件触发下,该HAB即可实现与小口径血管的共形、稳定无缝整合,在无外力塑形且无缝合下,重新连接两段断裂的血管。整合后的界面剪切强度> 70 kPa,并可承受类似主动脉径流流速的高流速血液(85 mm·s-1)剪切冲击。
该研究实现了与高曲率组织的共形、稳定且生物相容的界面适配,对于促进组织工程支架和神经电子等植入式生物医用材料/器械的生物界面适配以增强其植入后的安全性和功能可靠性提供了创新策略和思路。上述研究工作得到了国家重点研发计划、国家自然科学基金、中科院青促会、广东省、深圳市等科技项目资助。

论文上线截图
论文链接:https://pubs.acs.org/doi/10.1021/acsami.2c10117