深圳先进院王立平团队揭示快速眼动睡眠参与本能恐惧反应的神经机制
1月22日,中国科学院深圳先进技术研究院、深港脑科学创新研究院王立平团队在Neuron杂志在线发表了题为“The subthalamic corticotropin-releasing hormone neurons mediate adaptive REM sleep responses to threat”的研究论文[1],首次揭示了调控快速眼动睡眠与本能防御行为的“共享”神经环路,此大脑的“节能”模式的建立可能在进化过程中因适应环境的挑战而得到了发展和强化,此“共享”环路的发现揭示了快速眼动睡眠具有潜在“防御天敌”的功能。这是继2019年团队在Neuron发表“A VTA GABAergic neural circuit mediates visually evoked innate defensive responses”研究成果后[2],在“本能恐惧行为的神经环路”解析方面的又一重要进展。

论文上线截图
“日求三餐,夜求一宿”,睡眠是物种在自然界得以生存繁衍的重要需求和基本保障。但是,每个人一生中可能都有过类似经历:被生活中的“烦心事”所困扰;第二天有“压力山大”或者需要高度重视的事情,比如考试、面试、晋职答辩等,这些情况下当天晚上会睡不踏实,第二天早晨起床就感觉很疲劳。生活中存在的这些压力事件可能会持续地影响睡眠质量,严重时也会影响心情状态,导致晚上很容易做梦。大部分的梦境都发生在快速眼动睡眠中,提示我们快速眼动睡眠和压力事件有着紧密的联系,而快速眼动(REM)睡眠自1953年被认识以来,其发生机制和功能一直是个谜团。
自然界中的动物有着复杂的生存环境,环境中有同伴、食物、也有天敌或其他突发的环境刺激、抑或可能的诱惑。物种为了生存,首先要面对天敌时“不被吃掉”而产生本能恐惧反应:躲避、原地装死或者从危险区域逃到安全区域。这个过程中,大脑要时刻保持天生的对外界突发的、对生命有威胁的信息快速处理的状态和能力,否则“难逃一劫”。但是,一天24小时中,如果始终处于持续的“警觉”状态而得不到休息,那么物种也无法生存。这就需要按照周围环境中天敌出没的规律,大脑适应地建立了物种独特的机体节律特征:“日出而作,日入而息”或者“昼伏夜出”。总之,需要睡眠。人类睡眠的特征与其他多物种的睡眠特征具有高度的保守性。我们人类虽然没有了自然界中的“天敌”,但是,诸多社会生活和其他环境因素的存在成为了大脑压力的主要来源。
然而,睡眠过程中机体肌肉松弛,对环境感知下降,在危机四伏的自然界中睡眠是一种“高风险行为”,一定程度上增加了被天敌捕获的几率。在漫长的物种演化过程中,动物是否存在睡眠和对天敌的防御行为优化的平衡机制,以保证通过睡眠进行个体稳态维持的同时,又尽可能地逃避潜在天敌来临时的危险,这对于最优化的动物生存和繁衍至关重要。
睡眠包含两种状态:非快速眼动睡眠(non-rapid eye movement,NREM)和快速眼动睡眠(rapid eye movement,REM)。这两种状态从脑电波,眼动,脑血流变化等方面都截然不同。NREM睡眠又称慢波睡眠,特点是全脑神经元同步化放电,大脑处于低活动状态,类似于“睡的深,睡的香”的状态;而REM睡眠呈现快速,去同步化放电,大脑整体活动水平较高,基于REM睡眠后常伴随着周期性的短暂觉醒现象。早在1966年美国心理生理学家Frederick Snyder就提出REM睡眠或许扮演“哨兵功能”的假说[3, 4],认为REM睡眠期间,可能允许动物能够监测周围环境并做好天敌攻击时逃跑的准备,但多年来未能提供实验证据支持。
大脑中的睡眠“哨兵”
王立平团队使用自主研发的小动物眼动监测方法结合脑电肌电记录,发现相较于NREM睡眠,REM睡眠期间给予天敌气味能够更快唤醒小鼠,且醒来后唤醒程度更高,这提示REM睡眠可能扮演着睡眠中“哨兵”的角色,用以快速感知环境中可能的威胁(图1)。
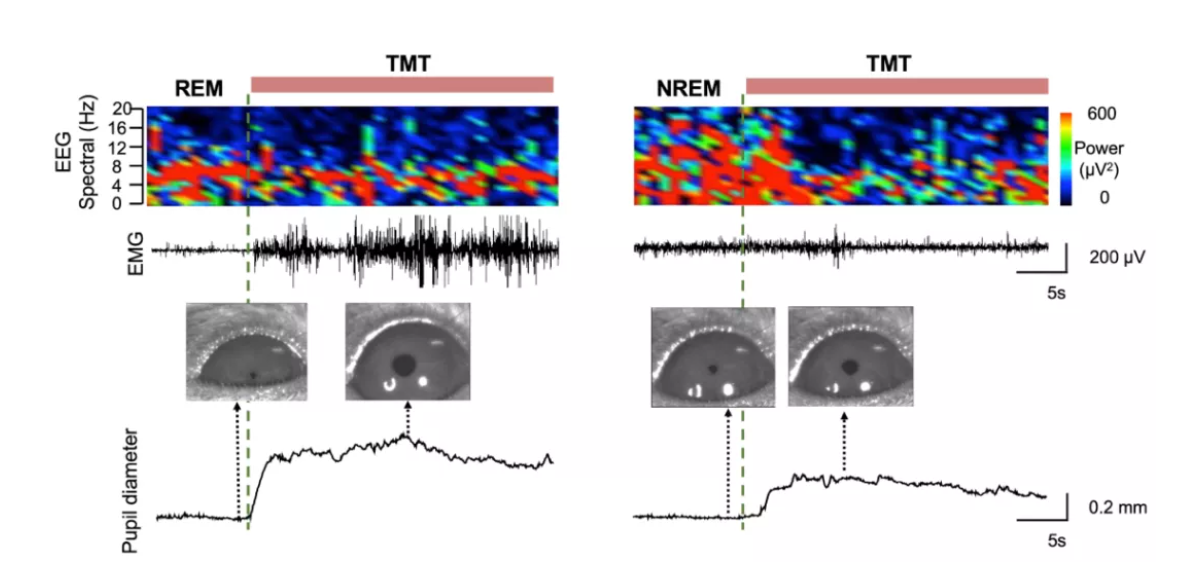
图1 REM和NREM睡眠下对天敌刺激的响应
mSTN-CRH-LGP神经环路调控快速眼动睡眠及清醒状态下对天敌刺激的响应
在此研究中,研究团队综合使用光纤记录,光/药物遗传学调控及内窥镜单神经元成像,解析了一条从丘脑底核(medial subthalamus nucleus, mSTN)促肾上腺皮质激素释放激素(corticotropin releasing hormone , CRH)神经元投射到外侧苍白球(lateral globus pallidus, LGP)的神经环路,介导了快速眼动睡眠下对天敌刺激的响应,抑制这群神经元缩短了快速眼动睡眠的长度,但延长了天敌刺激诱发觉醒的潜伏期。在动物觉醒情况下,这群神经元同样参与对本能恐惧刺激的调节。此外,通过给予小鼠慢性天敌压力刺激,发现小鼠REM睡眠结构显著改变,表现为REM睡眠时间的延长和睡眠的片段化,但在压力刺激期间化学抑制mSTN-CRH神经元活性则减弱了小鼠REM睡眠结构的改变。
现代生活中,与压力恐惧失调相关精神疾病如抑郁症和创伤后应激综合症中常见REM睡眠的改变,此外在帕金森病患者中,本研究中所关注的丘脑底核是深部脑刺激的常用治疗靶点之一,这个靶点的刺激往往导致患者睡眠结构改变。此项研究不仅为REM睡眠的防御功能提供实验基础,还解析了其中一条调控REM睡眠与本能恐惧的“共享”环路。此研究不只以一种全新的方式来理解大脑在维持生命体适应环境的重要角色,也为睡眠障碍及本能恐惧失调相关精神疾病共患病的诊断与治疗提供了可能的靶点。
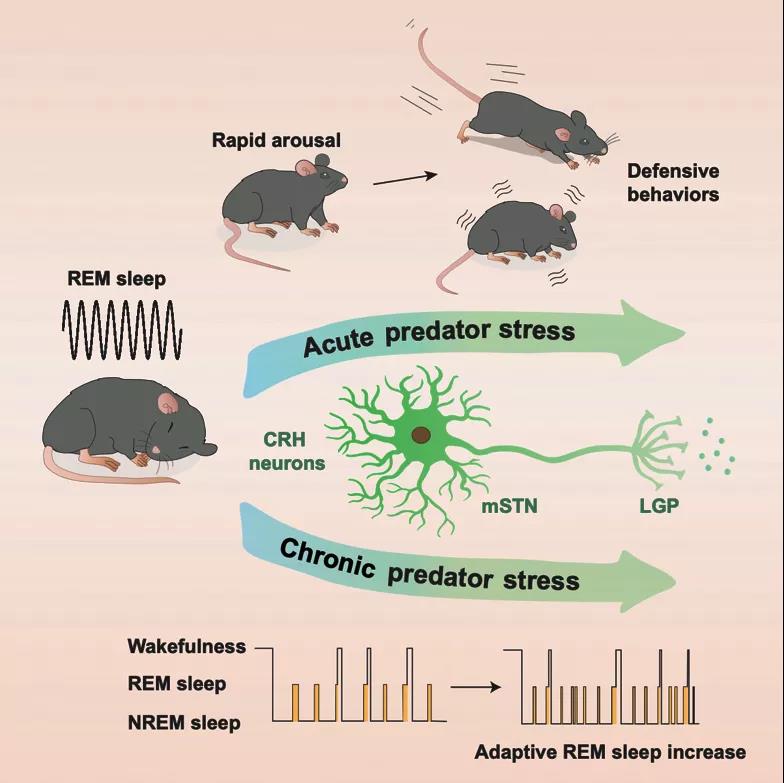
图2 mSTN-CRH-LGP神经环路调控REM睡眠和防御行为
深圳先进院王立平研究员为该文章的通讯作者,助理研究员曾渝婷、研究助理赵炳皓、在读博士生陈善平为论文共同第一作者。
研究得到国家自然科学基金委、中国科学院等相关部门的资助,并受到广东省重点领域研发计划项目的支持。
原文链接:
https://doi.org/10.1016/j.neuron.2021.12.033
参考文献:
1. Tseng, Y., et al., The subthalamic corticotropin-releasing hormone neurons mediate adaptive REM-sleep responses to threat. Neuron, 2022. 110.
2. Zhou, Z., et al., A VTA GABAergic Neural Circuit Mediates Visually Evoked Innate Defensive Responses. Neuron, 2019. 103(3): p. 473-488.e6.
3. Snyder, F., Toward an evolutionary theory of dreaming. Am J Psychiatry, 1966. 123(2): p. 121-42.
4. Lima, S.L., et al., Sleeping under the risk of predation. Animal Behaviour, 2005. 70(4): p. 723-736.




