Angewandte Chemie | 肠道菌群暗藏“江湖”,核糖体肽巧扮“杀器”
12月10日,中国科学院深圳先进技术研究院合成生物学研究所(以下简称“合成所”)司同课题组和南京大学化学化工学院的王欢课题组合作,在国际化学期刊 Angewandte Chemie 中发表了题为 Biosynthesis of Gut-Microbiota-Derived Lantibiotics Reveals a Subgroup of S8 Family Proteases for Class III Leader Removal 的文章。本工作首次报道了具有特异性识别位点的肽酶可以参与III型羊毛硫肽生物合成过程。

文章首页截图
文章链接:Biosynthesis of Gut‐Microbiota‐Derived Lantibiotics Reveals a Subgroup of S8 Family Proteases for Class III Leader Removal - ZHANG - - Angewandte Chemie International Edition - Wiley Online Library
在长期共同进化中,肠道菌群与宿主共同构成超级生物体,一起成长,一起变老,度过或长或短的一生。肠道菌群作为超级生物体不可分割的一部分,对宿主有着重要的影响,也因此被喻为“隐形的器官”,这一“器官”健康与否就取决于菌群的种类和结构。由于肠道是这个星球中微生物最为密集的地方之一,这些肠道菌面临着巨大的“内卷”压力,它们要如何才能脱颖而出呢?
肠道菌群作为超级生物体不可分割的一部分,对宿主有着重要的影响,它们有的训练宿主免疫系统躲过追杀(瞒天过海),有的通过转化宿主代谢物炼制毒药(借刀杀人)。但是,最有效的“卷”法还是要自己能打,通过苦练修习将武功外化为独门武器——抗生素,在必要时放倒或者杀死别的肠道菌。
在之前的研究中,科学家发现包括人类在内的动物体内,肠道菌能产生丰富的抗生素武器,形成了血雨腥风的微生物江湖。江湖中不同门派流传着各自的独家武功秘籍,又叫生物合成基因簇(Biosynthetic Gene Cluster,BGC)。这些秘籍用ATCG四种字母记载,篇幅有长有短(通常为10-100kb,或者1万到10万字)。其中有一大门派,其武功秘籍篇幅较短(1万字左右)、容易习得,使用的武器叫做“翻译后修饰核糖体多肽(Ribosomally synthesized Post-translationally modified Peptide, RiPP)。由于RiPP发音和英文中排骨Rib的发音一致,因此江湖人称“排骨派”。
排骨派声势浩大,分舵堂口众多,说来话长,今天着重讲一讲叫lanthipeptide的这一分舵,中文名叫羊毛硫肽。其名字来源与羊排是否有关,众说纷纭,已是谜案,按下不表;但通过研究动物肠道菌中羊毛硫肽分子及其生物合成过程,将有助于解析肠道菌间的相(ai)互(hen)作(qing)用(chou),进而理解菌群种类和结构如何影响宿主疾病和健康。
该研究在模式动物大鼠肠道菌中发现了一类新颖的窄谱羊毛硫肽抗生素amylopeptins,解析了基因簇内S8家族丝氨酸肽酶AmyP如何参与前导肽移除和抗生素活性的激活。南京大学博士后章盈盈,合成所助理研究员洪志来、合成所博士后周亮(已出站)为论文共同第一作者,王欢教授和司同研究员为论文共同通讯作者。
有意思的是,两位共同通讯作者也“是出同门”,都曾在美国科学院院士Wilfred van der Donk课题组进行过博士后研究。江湖传言,van der Donk课题组与逍遥派有着共同之处,此处附上三人照片供读者自行体会。

书归正传,课题组前期从大鼠肠道中分离得到一系列肠道菌株;基于生物信息学分析,研究人员破译了这些微生物基因组中可能存在的“武功秘籍”,预测可能存在多个新颖羊毛硫肽基因簇(“不同门派”)。通过菌群互作实验(“比武”),也进一步推测这些产物可能是具有抗生素活性的“武器”。基于新颖性分析,本工作重点关注Bacillus amyloliquefaciens基因组编码的一个III型羊毛硫肽基因簇,簇中含有不同的招式:(1)可能对应7种不同产物的7条前体肽;(2)一个新颖III型羊毛硫肽合成酶AmyKC;(3)一个S8家族的丝氨酸肽酶AmyP以及一个转运蛋白AmyT。如图1所示。
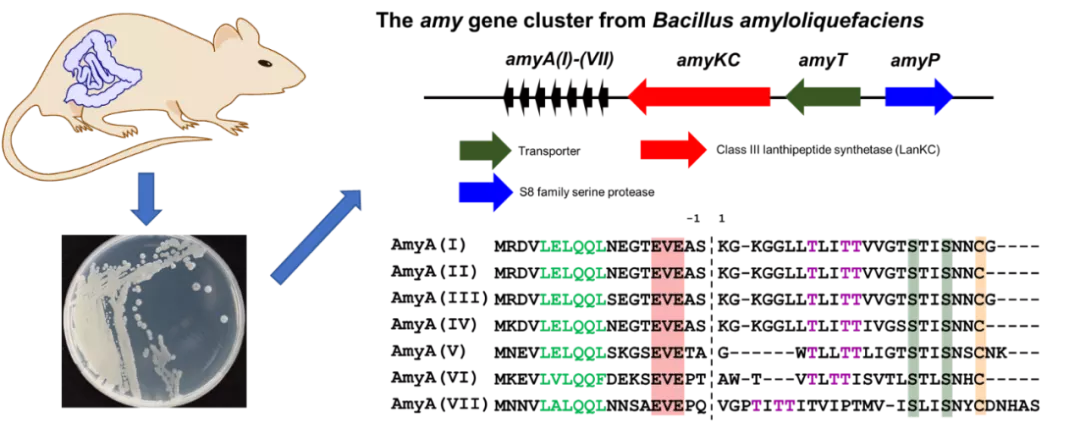
图1 基因组挖掘(genome mining)从大鼠肠道菌中得到一个新颖的III型羊毛硫肽基因簇
结合大肠杆菌异源表达和体外生化反应,研究人员成功获得III型羊毛硫肽产物,结合高分辨质谱、点突变实验以及化学衍生等手段对多肽的化学结构进行了鉴定:其中AmyA(I)和AmyA(V)均具有labionin的特征结构而AmyA(VI)则只具有线性的多肽结构。这一结果显示AmyKC具有良好的底物宽泛性,并能特异性地对多肽进行不同程度的修饰,获得多样性的产物。最近的一系列研究表明,同一个羊毛硫肽基因簇合成多种产物似乎是肠道菌羊毛硫肽基因簇的特征,而在环境菌中较为罕见。这也暗示了肠道中的“微生物江湖”比其他环境更为险恶,微生物不得不随身携带多种武器用于防身。如图2所示。
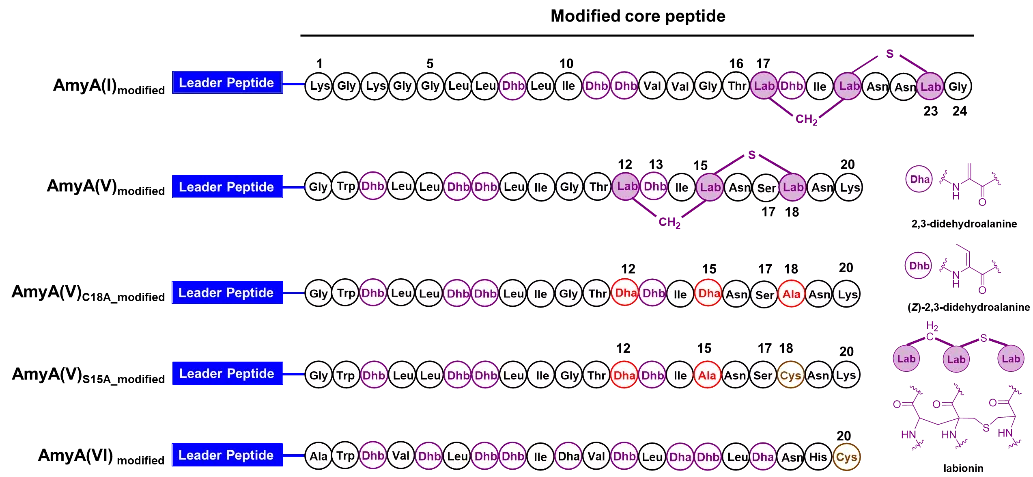
图2 III型羊毛硫肽amylopeptins的结构及其鉴定
携带刀剑时必须入鞘,否则难免误伤自己,而前导肽就是羊毛硫肽的“刀鞘”。因此,前导肽移除是激活羊毛硫肽功能的重要步骤,但在III型羊毛硫肽生物合成过程相关研究十分有限。本研究中,研究人员发现重组AmyP可以特异性切割簇中编码的修饰后前体肽,并且结合点突变底物、同源底物实验鉴定了特异性识别位点。基于序列相似性网络、基因组挖掘等生信分析,研究人员发现这一机制在其他III型羊毛硫肽基因簇中广泛存在,并通过实验验证了AmyP类似蛋白酶的活性。这是S8家族丝氨酸肽酶参与III型羊毛硫肽前导肽特异性移除过程的首次报道。换句话说,研究者发现了这门武功中一种新的拔刀招式。
总结而言,amylopeptins生物合成途径可以分为两步,首先,核糖体编码产生的前体肽经由AmyKC催化的脱水及环化后;之后,修饰后前体多肽由S8家族的丝氨酸肽酶特异性切割,并释放终产物。如图3所示。
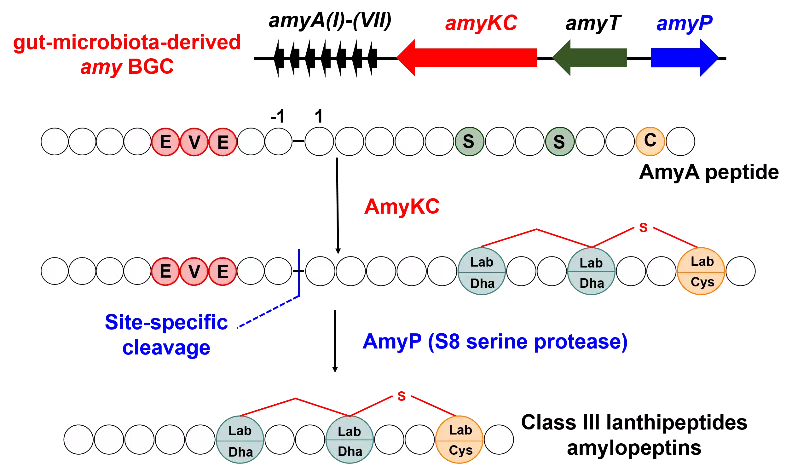
图3 amylopeptins的生物合成示意图
最后,研究人员对产物之一amylopeptin(I)进行生物活性表征,共测试了19株不同种属的大鼠肠道菌。抑菌实验表明,amylopeptin(I)仅对Bacillus megaterium显示出明显活性,可被认为是一种窄谱羊毛硫肽抗生素;而AmyP参与的前导肽移除对抑菌活性激活非常关键(图4)。有趣的是,Severinov课题组最近也表征了一个来自于Bacillus、具有额外N端二甲基化的III型羊毛硫肽andalusicin A,也是对两株Bacillus具有较强抑菌活性,提示微生物利用III型羊毛硫肽进行生态位竞争的现象在自然界中可能广泛存在。




