Angew. Chem | 蔡林涛研究员团队提出低温光热肿瘤治疗新思路:利用CO气体调控热休克蛋白表达
光热治疗(Photothermal therapy,PTT)作为一种肿瘤光学治疗策略,通过将光能转化为热能,可以有针对性地在局部杀死癌细胞,在恶性肿瘤治疗方面具有微创、长效、安全等特点,受到科研人员的广泛关注。然而强激光(局部温度到达50℃)在破坏肿瘤的同时可能导致肿瘤附近正常器官被灼伤。控制治疗温度不会引起正常组织损伤但治疗效果不理想。如何实现较低温度下(小于42℃)进行光热治疗(Mild-temperature PTT)对于癌症光学治疗的未来临床转化具有重要价值。热休克蛋白(Heat shock proteins, HSP)是一种在细菌和哺乳动物体内广泛存在的一类热应急蛋白。当生物体暴露于高温时会合成此种蛋白以保护自身。因此,在光热治疗过程中抑制热休克蛋白的合成能够降低肿瘤细胞的耐热性,从而提升肿瘤光热治疗的效果和降低治疗所需要的温度,最终达到肿瘤低温光热治疗的目的。
传统抑制热休克蛋白合成的方法主要通过化学小分子抑制剂(如:藤黄酸、17-AAG、JG-98等)或siRNA等方法实现。但是大多数化学小分子抑制剂往往水溶性差, 毒性大,而siRNA往往递送效率低且自身不稳定,极大限制了这些方法在低温光热治疗过程中的应用。科研人员一直在寻找更加有效的热休克蛋白抑制策略用于提高肿瘤低温光热治疗的效果。
气体治疗(Gas Therapy)作为一种新兴的治疗策略,在肿瘤治疗中越来越受到重视。许多治疗气体如一氧化碳、一氧化氮、硫化氢、氧气和二氧化硫在细胞、组织或有机体的各种生理过程中发挥重要的调控作用,因此在应对包括癌症在内的各种疾病治疗中显示出具有巨大的潜力。然而,从未有报道利用气体调控热休克蛋白来增强肿瘤低温光热治疗效果。
中国科学院深圳先进技术研究院医药所蔡林涛研究员团队与香港科技大学/香港中文大学(深圳)唐本忠院士团队合作,在前期研究基础上(ACS Nano 2020, 14, 9, 11452–11462),利用羰基铁合成了一种新型两亲性治疗气体载体材料(mPEG(CO)),通过与具有近红外二区发射的AIE聚合物光热材料进行共组装,构建了一种肿瘤微环境触发的AIE纳米载药系统(AIE纳米炸弹)。当纳米炸弹与肿瘤微环境中过表达过氧化氢相遇,就会迅速释放一氧化碳气体。令人意想不到的是,所产生的一氧化碳气体不仅可以在一定程度抑制肿瘤细胞的快速增殖,同时在利用AIE材料进行光热治疗过程中,可以有效的抑制热休克蛋白的过表达,从而提高肿瘤低温光热治疗的效果。
相关研究成果以“H2O2-Responsive NIR-II AIE Nanobomb for Carbon Monoxide Boosting Low-Temperature Photothermal Therapy”于2022年7月15日在线发表在《德国应用化学》(Angewandte Chemie; Angew. Chem. Int. Ed., 2022, Accepted, DOI: 10.1002/anie.202207213)上。文章的第一作者是中国科学院大学/中国科学院深圳先进技术研究院的博士生马功成。文章共同通讯作者是中国科学院深圳先进技术研究院医药所蔡林涛研究员,龚萍研究员,张鹏飞副研究员和湘潭大学陈华杰教授。该项目得到中国科技部政府间国际科技创新合作重点专项及合成生物学专项、国家自然科学基金、深圳市基础研究项目等基金的支持。

论文上线截图
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202207213
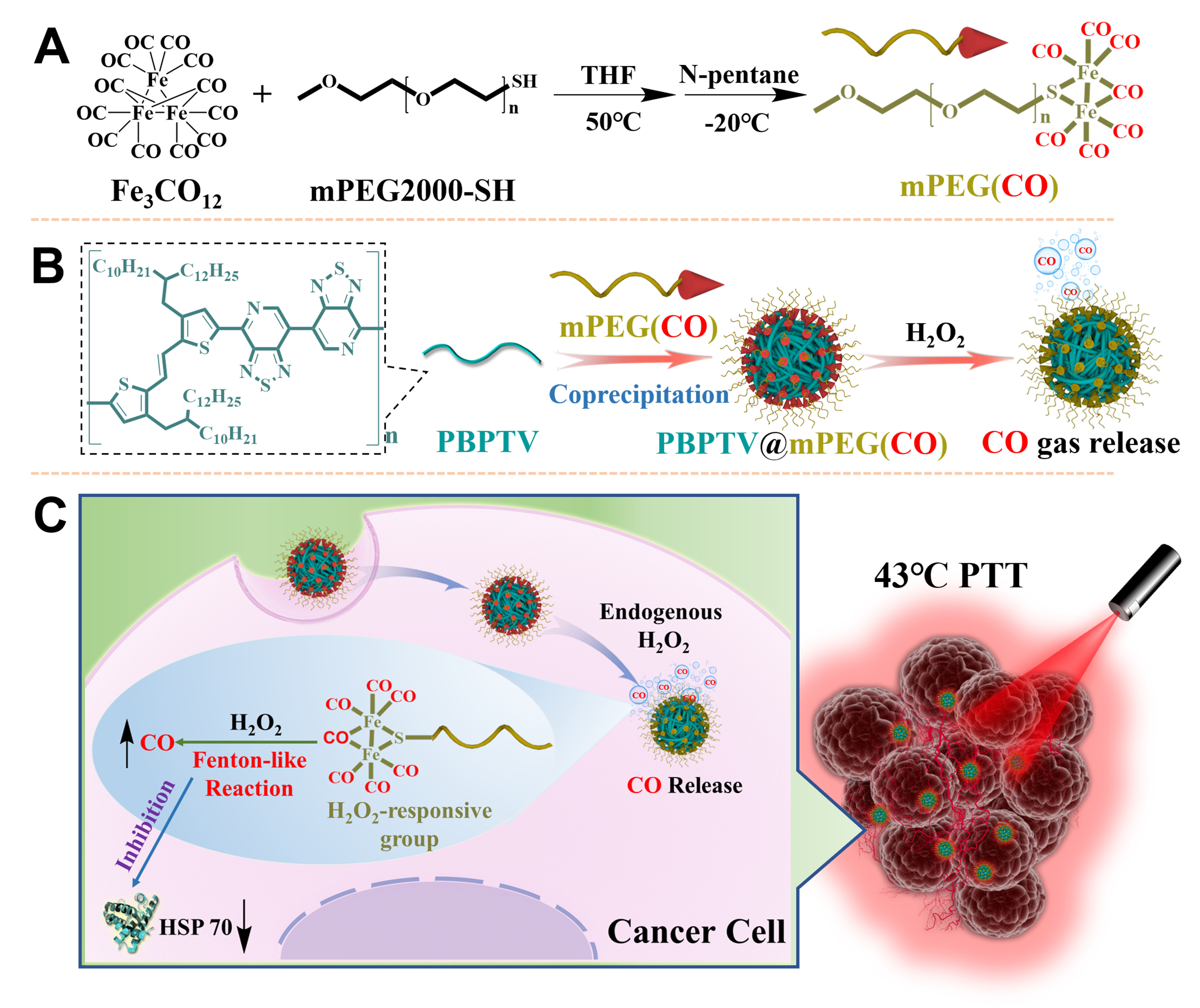
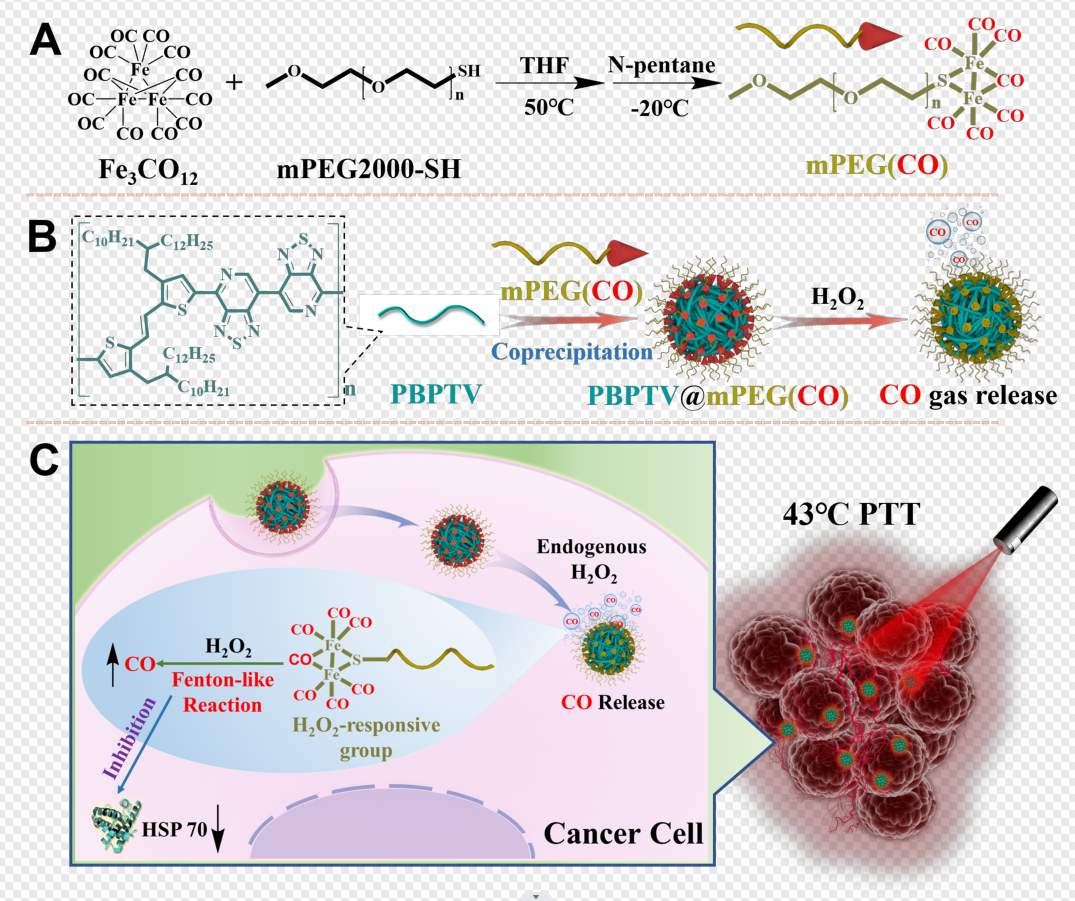
图1. AIE纳米炸弹构建及其用于肿瘤低温光热治疗作用机理示意图:(A)新型一氧化碳聚合物载体的合成路线;(B)纳米炸弹组成的示意图;(C) 纳米炸弹的癌症低温治疗过程示意图。
该工作中,研究人员使用十二羰基三铁和巯基聚乙二醇(mPEG2000 SH)合成了聚合物载体材料mPEG(CO),并进一步将mPEG(CO)与AIE聚合物材料PBPTV共组装,形成直径约71 nm的纳米杂化聚集体(PBPTV@mPEG(CO))。该聚集体在808 nm激光的激发下,可发射强烈的近红外荧光,光谱可拖尾进入近红外二区波段。同时该聚集体具有高达38.1%的光热转化效率。进一步研究表明,过氧化氢(H2O2)的存在可触发纳米杂化聚集体如炸弹爆炸般在局部范围短时间内释放大量的CO气体。
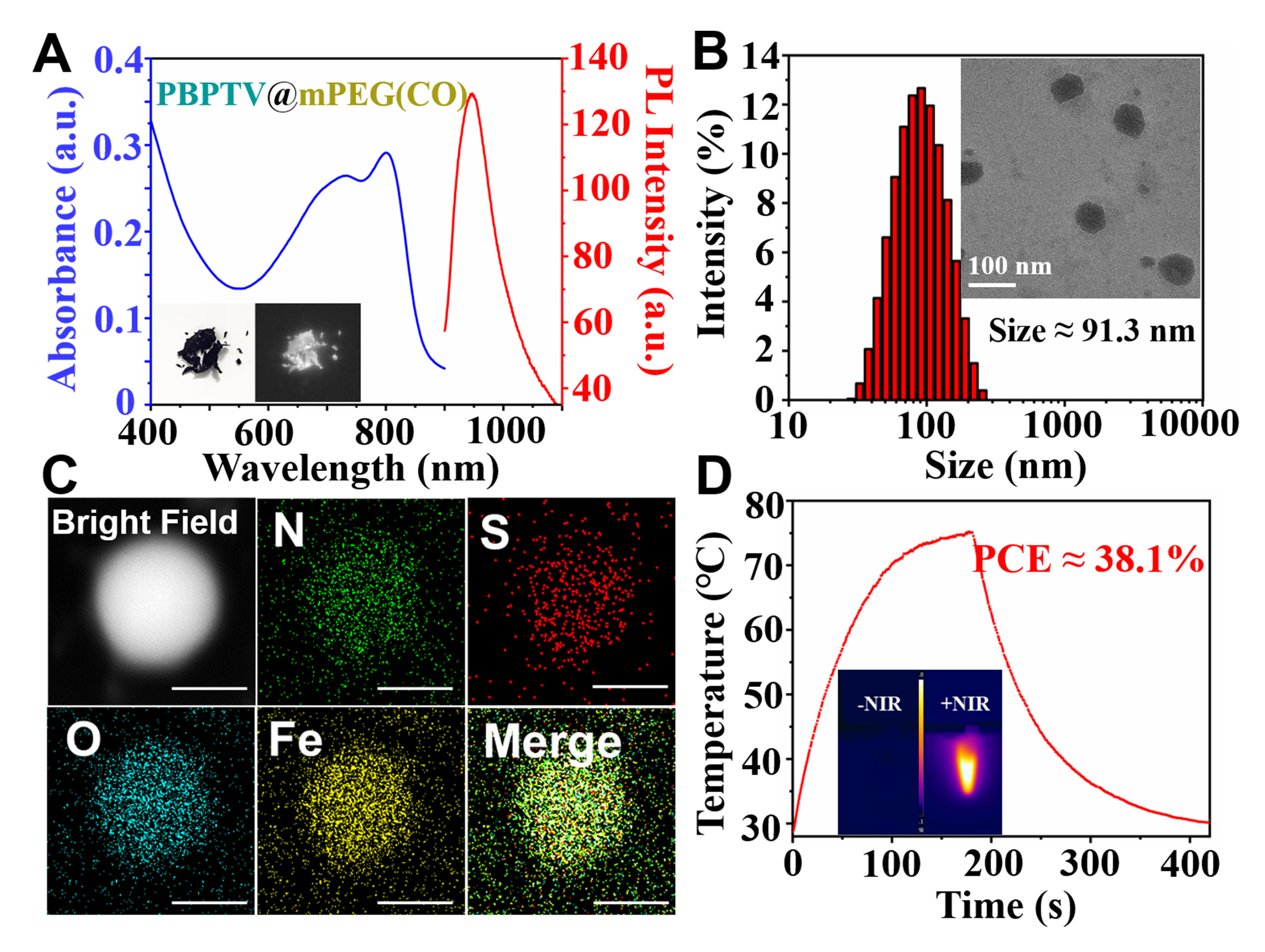
图2. (A) 纳米炸弹水溶液的紫外吸收光谱(蓝色)和荧光发射光谱(红色);(B) 通过TEM和DLS测量出纳米炸弹的粒径。比例尺100 nm;(C) 纳米炸弹的EDS元素分析。比例尺50 nm;(D) 在808 nm近红外激光下,热成像相机记录的纳米炸弹溶液升温曲线。实验结果表明纳米炸弹具有稳定的颗粒性质及优良的光热性能。
图3. (A)紫外光谱曲线变化揭示经还原血红蛋白测试的纳米炸弹溶液中CO的释放过程;(B)共焦荧光显微镜成像癌细胞和正常细胞中CO的表达。比例尺10 mm。实验结果表明纳米炸弹能够响应过表达的过氧化氢并释放CO气体。
进一步细胞实验表明,当将该纳米聚集体分别与肿瘤细胞与正常细胞共孵育后进行低温光热治疗,仅在肿瘤细胞存在的情况下释放CO气体,而在正常细胞存在的情况下并不释放。肿瘤细胞的增殖得到有效抑制。免疫印迹分析结果表明,当纳米聚集体存在时,低温光热处理的肿瘤细胞中的热休克蛋白表达水平得到极大抑制。研究结果表明,肿瘤细胞中过量表达的双氧水促进了纳米聚集体中CO气体的释放,从而抑制了热休克蛋白的合成,降低肿瘤细胞的耐热性,从而提升了肿瘤低温光热治疗的效果。而正常细胞由于热休克蛋白表达过程不受影响,因此避免了光热治疗对其造成的损伤。
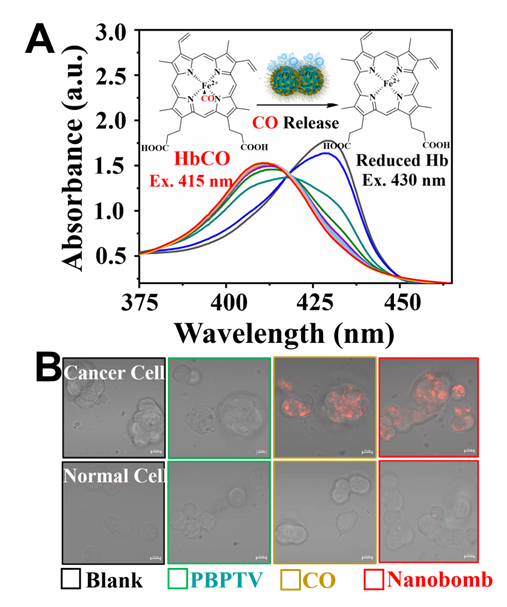
图4. (A)细胞死活染色实验,红色代表死细胞,绿色代表活细胞。比例尺300 mm;(B)细胞在不同实验条件下处理后HSP70蛋白的表达水平对比。实验证明纳米炸弹能够有效抑制癌细胞在光热升温作用下HSP70蛋白的表达,从而提高低温光热治疗癌症的效率。
为了进一步证实该策略的临床转化潜力,研究人员开展了初步的小动物实验,结果表明,注射了PBPTV@mPEG(CO)纳米聚集体的小鼠在低温光热治疗下,肿瘤生长得到极大抑制,同时,免疫荧光成像结果表明,肿瘤部位的热休克蛋白表达受到极大抑制。同时,治疗过程中小鼠体重没有明显变化,血液生化指标显示正常,说明该纳米聚集体在提高肿瘤低温光热治疗的巨大转化潜力。
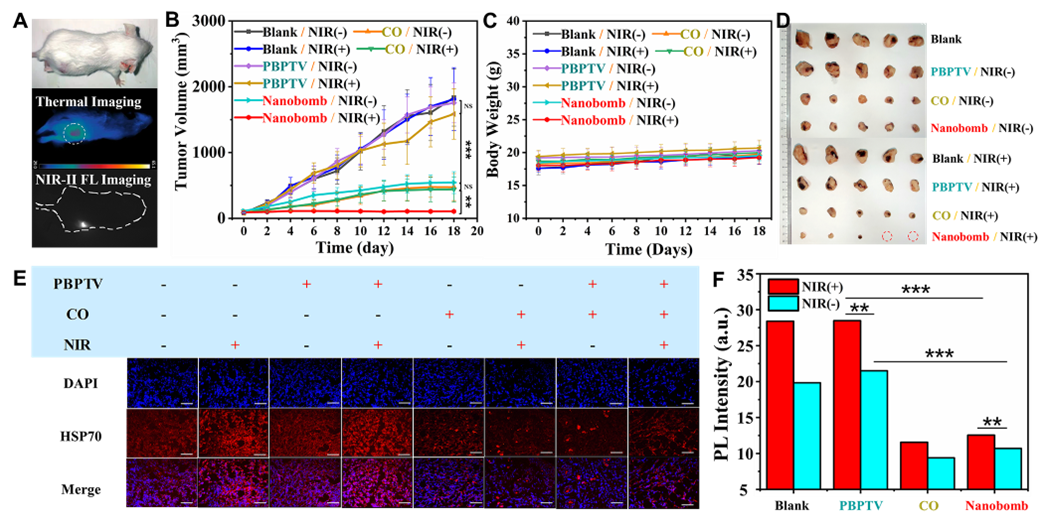
图5. (A)荷瘤小鼠的光热治疗过程图片和NIR-II荧光成像图片;(B)18天内小鼠肿瘤体积变化曲线;(C)治疗期间小鼠的体重变化;(D)治疗后的小鼠肿瘤照片。(E)肿瘤组织染色切片显示不同实验条件处理下HSP70的表达。比例尺100 mm;(F)不同实验条件处理下肿瘤组织表现出显著差异。(*P<0.05,**P<0.005和***P<0.0005)。实验结果表明纳米炸弹能够抑制小鼠肿瘤中HSP70的表达,成功实现癌症低温光热治疗。
综上所述,这项工作开发了一种新型的AIE纳米气体药物递送系统,首次提出一种基于一氧化碳气体抑制热休克蛋白的独特策略,为肿瘤低温光热治疗提供新的思路。目前,该研究团队正在进一步探索一氧化碳气体抑制热休克蛋白表达的分子机制,此项研究不仅为气体治疗的生物医学应用打开了一扇新的窗户,同时为肿瘤低温光热治疗提供新的思路。
期刊介绍:
《德国应用化学》(Angewandte Chemie)创刊于1888年,是德国化学学会(GDCh)的官方期刊并由Wiley–VCH出版。作为化学领域的权威期刊,《德国应用化学》涵盖了化学研究的各个领域,刊发包括新闻、综述、观点、通讯、研究论文等在内的各种内容。