深圳先进院在肝癌发病机制方面取得新进展
近日,中国科学院深圳先进技术研究院医药所抗体药物研究中心万晓春研究员及其研究团队在肝癌发病机制方面取得新进展。相关论文CD317 activates EGFR by regulating its association with lipid rafts(CD317通过调控EGFR与脂筏的相互作用激活EGFR)在线发表于AACR旗下顶级期刊Cancer Research(IF=9.13)上(DOI: 10.1158/0008-5472)。论文第一作者是助理研究员章桂忠。
表皮生长因子受体(EGFR)调控增殖、代谢以及分化等多种基本的细胞进程,而它的组成型激活是一个常见的癌症驱动因素。EGFR靶向疗法对肺癌、结肠癌等患者的生存具有显著的好处,但随后几乎不可避免的产生耐药性。此外,EGFR在40-70%的肝细胞肝癌(HCC)中表达增强,但EGFR抑制剂对未筛选HCC患者的生存并没有明显的益处。因此,深入研究以更好地理解EGFR信号的调控机制,对癌症尤其是肝细胞癌的靶向治疗策略开发和优化尤为重要。
EGFR是一种酪氨酸激酶受体,定位于细胞膜脂筏上以保持未激活状态。当其与EGF、TGF-α或AREG等配体结合后,从脂筏中释放出来并在非脂筏胞膜上形成二聚体从而活化。目前认为,在肿瘤发病过程中EGFR过度活化机制主要是EGFR和/或配体过表达,但这并不足以解释耐药性和EGFR抑制剂对HCC无效的临床问题。因此,万晓春研究团队经过深入研究发现,CD317,一种具有独特拓扑结构的表面分子,在HCC细胞中表达上调,通过调控EGFR在脂筏上的定位激活肝癌细胞EGFR信号,从而加速细胞周期进展,促进肿瘤发展。这些结果揭示了一种新的EGFR调控模式以及该模式在肝细胞肝癌发病过程中的作用,为肝细胞癌以及其他EGFR驱动型恶性肿瘤的治疗提供了新的靶点。
该项研究得到国家自然科学基金、深圳市科技计划项目的资助。
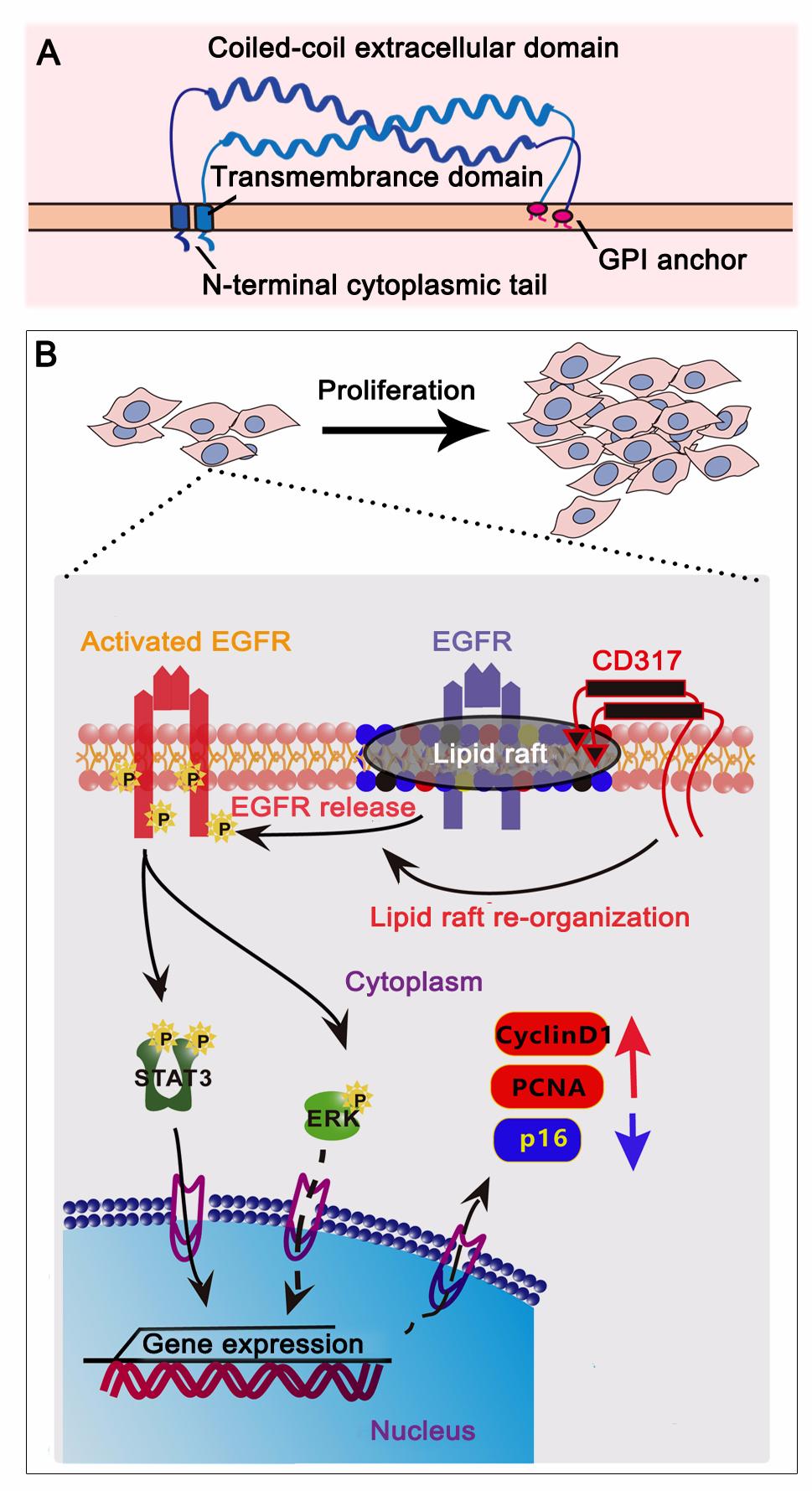
(A)CD317拓扑结构示意图; (B) CD317调控通过脂筏调控EGFR活化促进HCC进展。




