深圳先进院在CRISPR基因编辑应用领域取得新突破
近日,中国科学院深圳先进技术研究院喻学锋研究员课题组在CRISPR基因编辑应用领域取得新突破。相关工作"Enhanced Cytosolic Delivery and Releases of CRISPR/Cas9 by Black Phosphorus Nanosheets for Genome Editing"(用于基因编辑的黑磷增强型CRISPR/Cas9运载与释放系统)发表于化学材料领域的权威刊物Angewandte Chemie International Edition(DOI: 10.1002/anie.201806941,10.1002/ange.201806941,影响因子12.102)。论文共同第一作者是周文华博士和崔浩东研究助理,通讯作者是喻学锋研究员,参与作者还包括帝国理工学院Ying Liming教授。
近年来,CRISPR/Cas9系统作为一种源自原核生物获得性免疫系统的基因定点编辑技术,已被广泛应用于诸如基因表达调控、基因编辑以及核酸的原位检测等领域。然而,由于传统的针对编码DNA的转运手段存在着易导致靶细胞的插入缺失和过表达,并引起基因变异和脱靶效应等问题,限制了该技术的临床应用潜力。因此,开发出一种新的针对Cas9-sgRNA核酸-蛋白复合体的高效细胞转运/释放手段将具有重要的科学意义和应用前景。
黑磷因其良好的生物活性和生物相容性,以及其优越的光电特性,在生物医学领域受到广泛关注。喻学锋研究员课题组在之前研究中已成功将黑磷纳米材料应用于光声成像(Small, 2017, 13, 1602896)、肿瘤光热治疗(Nature Communications, 2016, 7, 12967)、肿瘤放射治疗(Biomaterials, 2018, 171, 12)、光致形变植入材料(Biomaterials, 2018, 164, 11)以及水凝胶敷料(Advanced Science, 2018, 5, 1700848)等领域。基于这些前期工作,以及在这些工作中发现的黑磷降解所引起的细胞内体(endosome)破裂现象,团队提出黑磷纳米片可用于生物活性大分子的细胞转运和释放。
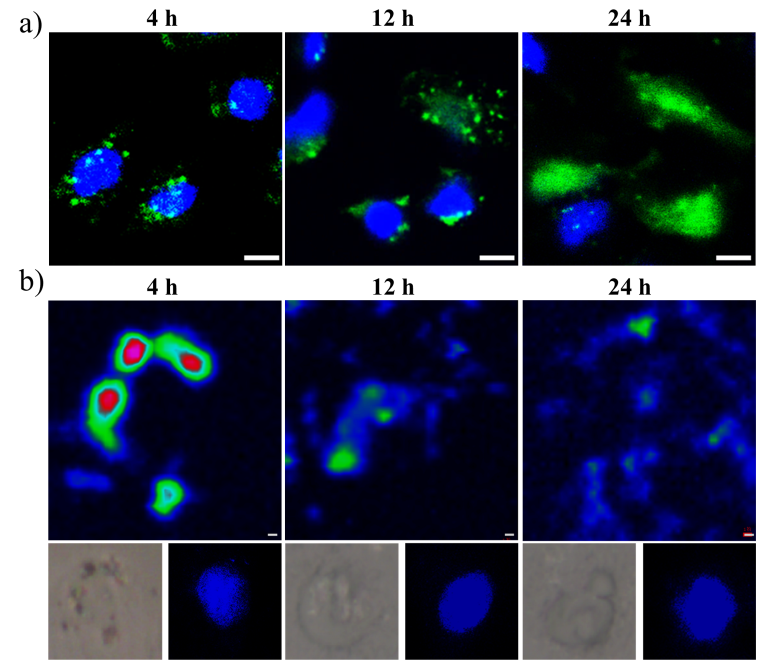
在本研究中,课题组以超薄二维黑磷纳米片为载体,通过静电相互作用对携带三核定位序列(3xNLS)的Cas9-sgRNA复合体实现高效负载,从而构建了一种高效的CRISPR/Cas9基因运载体系(图1)。该转运体系主要通过直接破膜和胞吞作用进入细胞内体,进入内体的黑磷载体在酸性环境下迅速降解为高度生物相容的无机磷酸盐,从而导致由渗透压改变所引起的内体破裂,实现Cas9-sgRNA复合体的高效胞内释放,并最终由所携带的三核定位序列靶向进入细胞核,完成基因编辑的功能(图2)。实验结果显示,相对于其他纳米材料载体,该基于黑磷纳米片的Cas9-sgRNA复合体转运体系可在较低浓度下完成对不同细胞株以及动物荷瘤模型的高效基因编辑和基因沉默(图3)。这一基于黑磷纳米片的高效细胞转运体系可进一步用于其他生物活性大分子的高效细胞转运,从而具有重要的医学研究和临床应用价值。相关工作已申请专利(CN108148874A),并依托孵化的中科墨磷科技有限公司(MoPhos.cn),积极推进相关技术的产业化。
该研究工作得到了中科院前沿科学研究重点计划、国家自然科学基金、深圳市科技计划国际合作研究、英国利华休姆信托基金等项目的资助。

图1: 基于黑磷纳米片的Cas9-sgRNA复合体转运体系细胞内作用示意图。
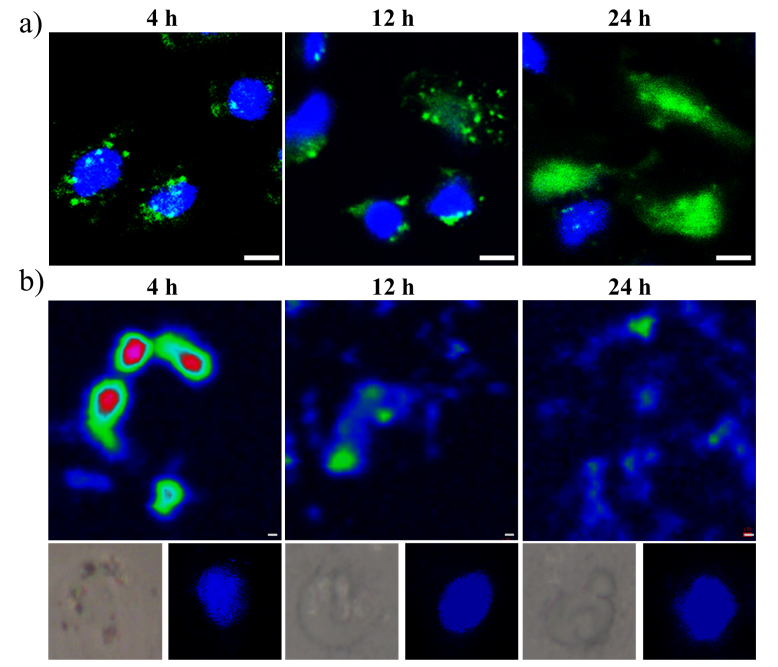
图2: 基于黑磷纳米片的Cas9-sgRNA复合体转运体系的(a)胞质输运以及核转运;和(b)黑磷纳米片在细胞内的降解过程。
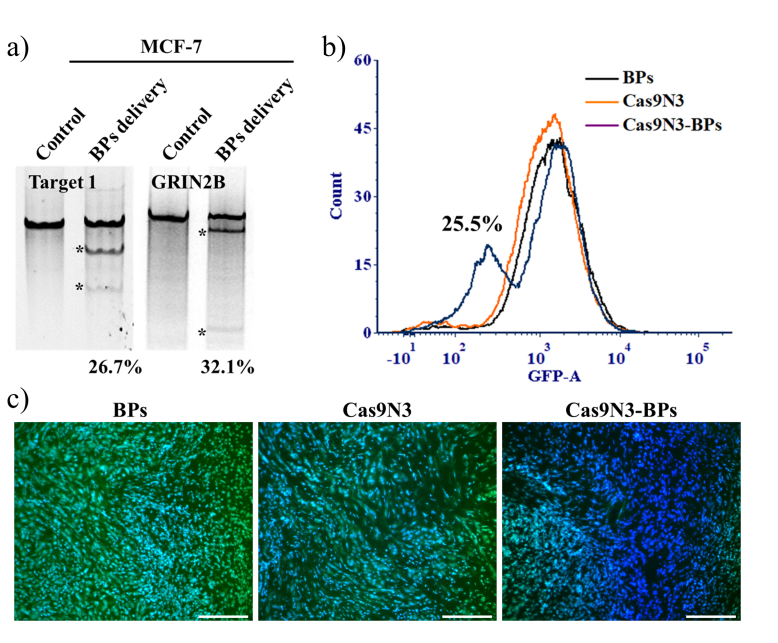
图3: 基于黑磷纳米片的Cas9-sgRNA复合体转运体系:(a)在细胞株MCF-7内实现高效的基因编辑;(b)在细胞株EGFP/A549及(c)动物荷瘤模型的EGFP位点实现了高效的基因沉默和基因编辑。